База данных по теплофизическим свойствам жидкометаллических теплоносителей перспективных ядерных реакторов
Теплофизические свойства жидкого калия и его пара
ТЕПЛОФИЗИЧЕСКИЕ СВОЙСТВА ЖИДКОМЕТАЛЛИЧЕСКИХ ТЕПЛОНОСИТЕЛЕЙ
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
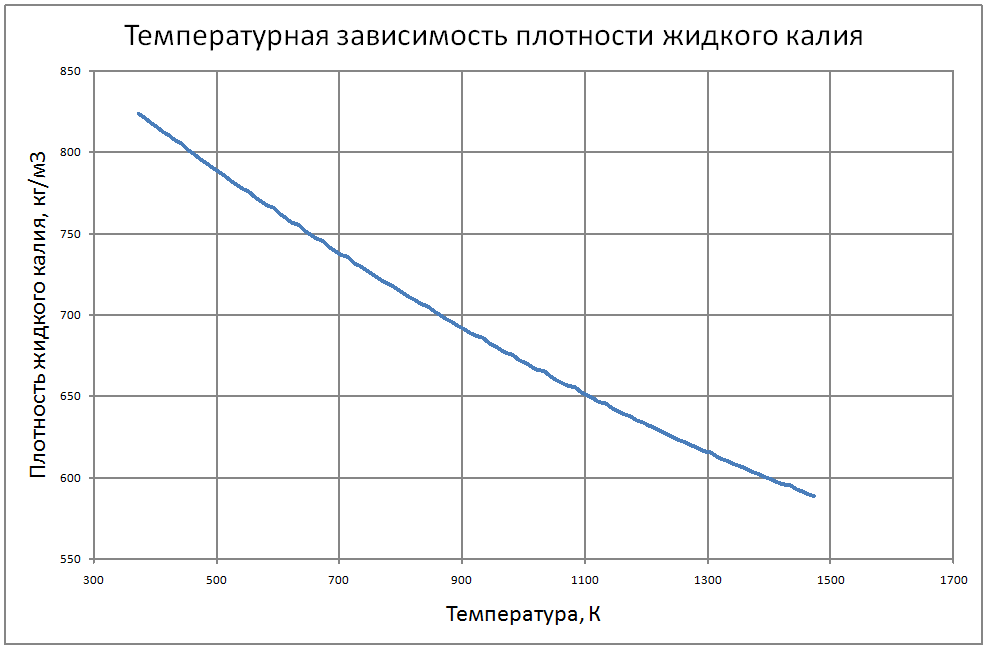
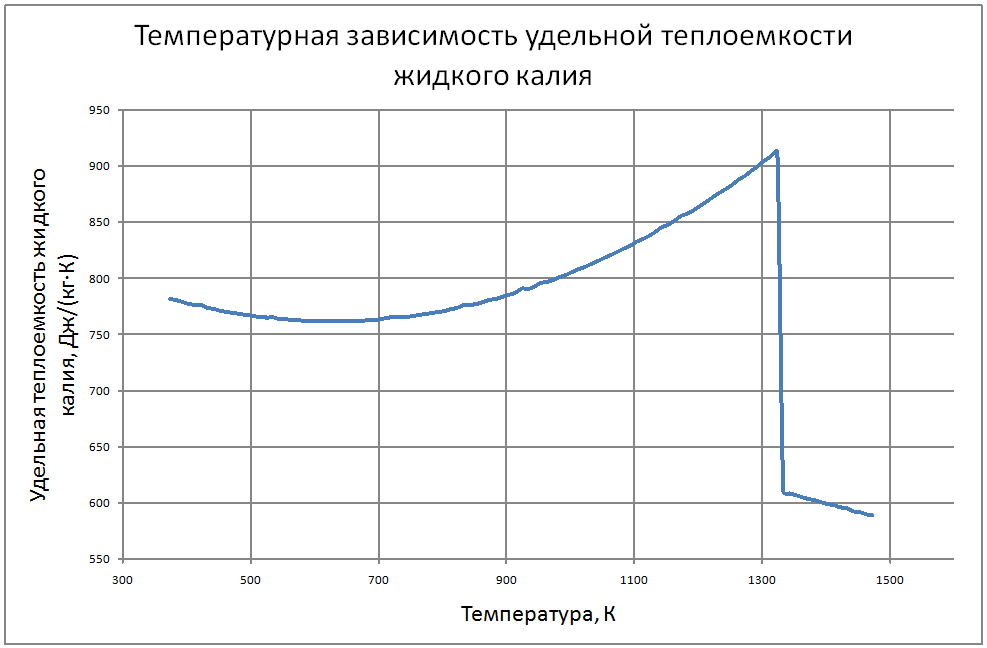
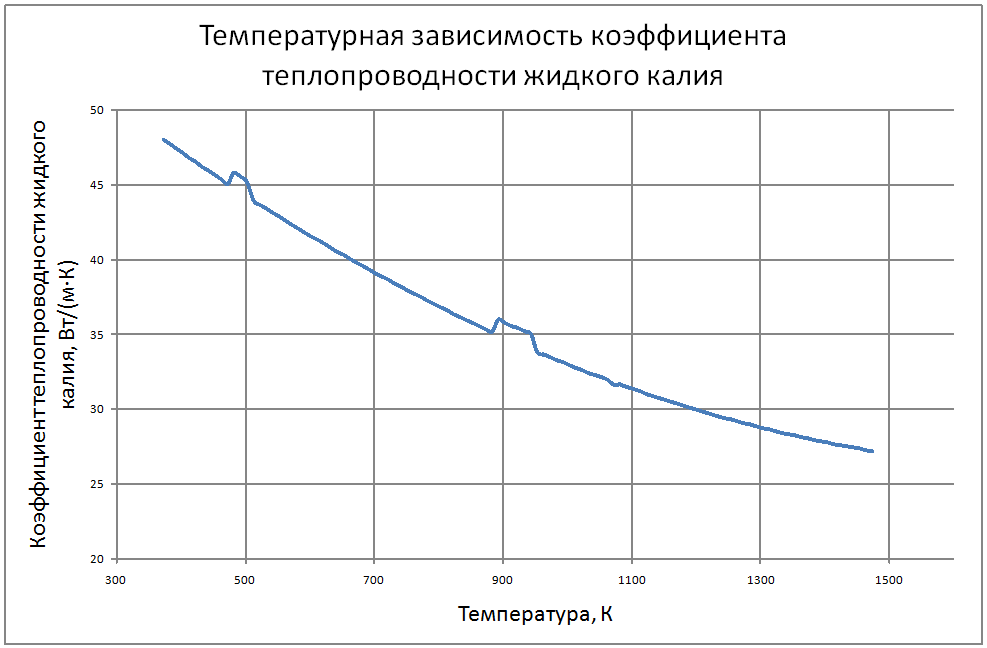
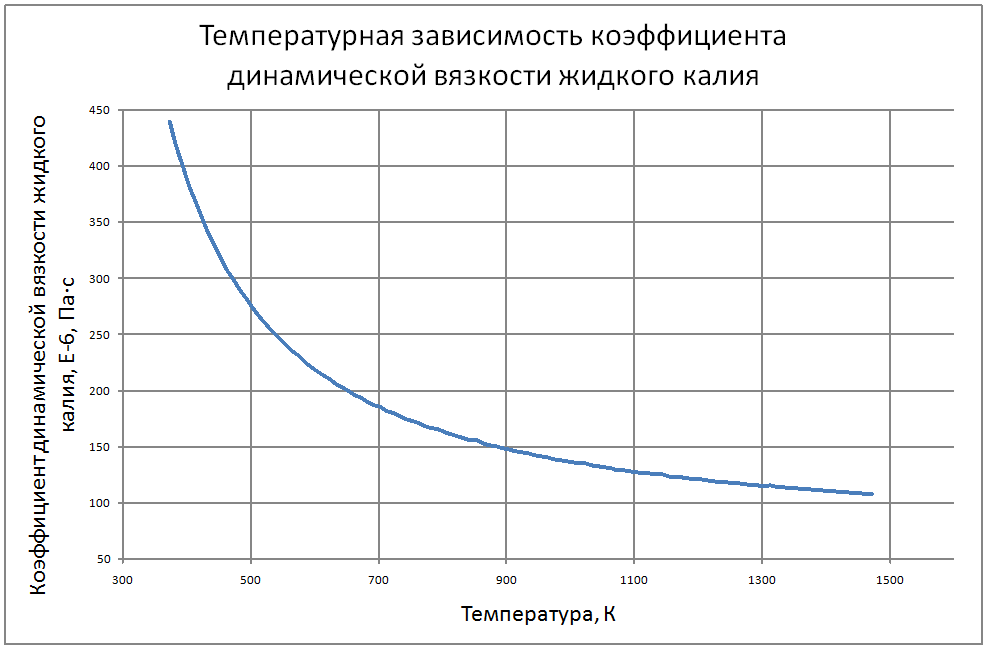
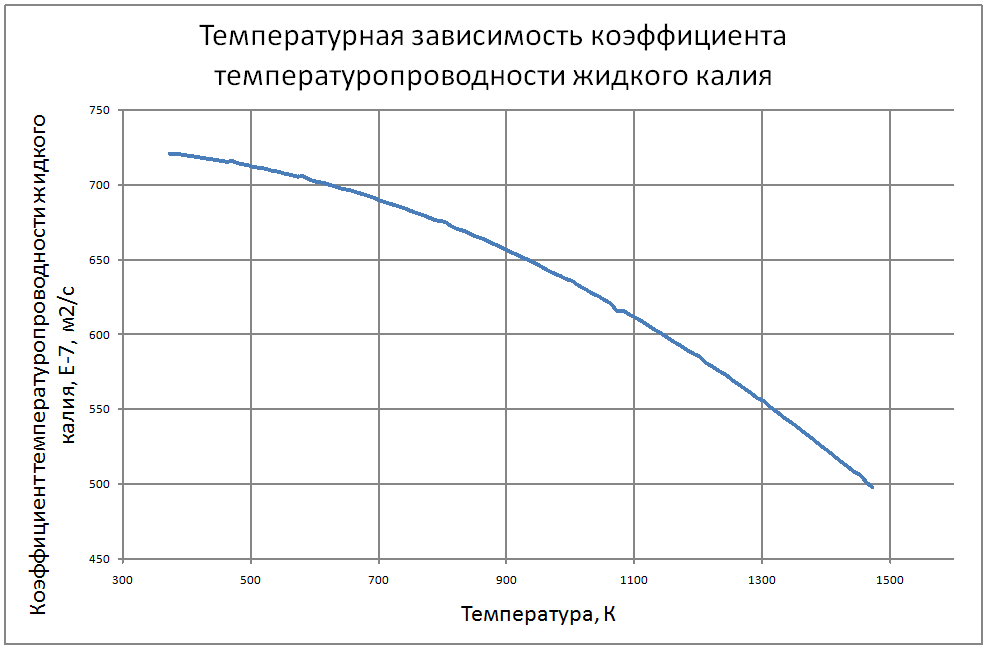
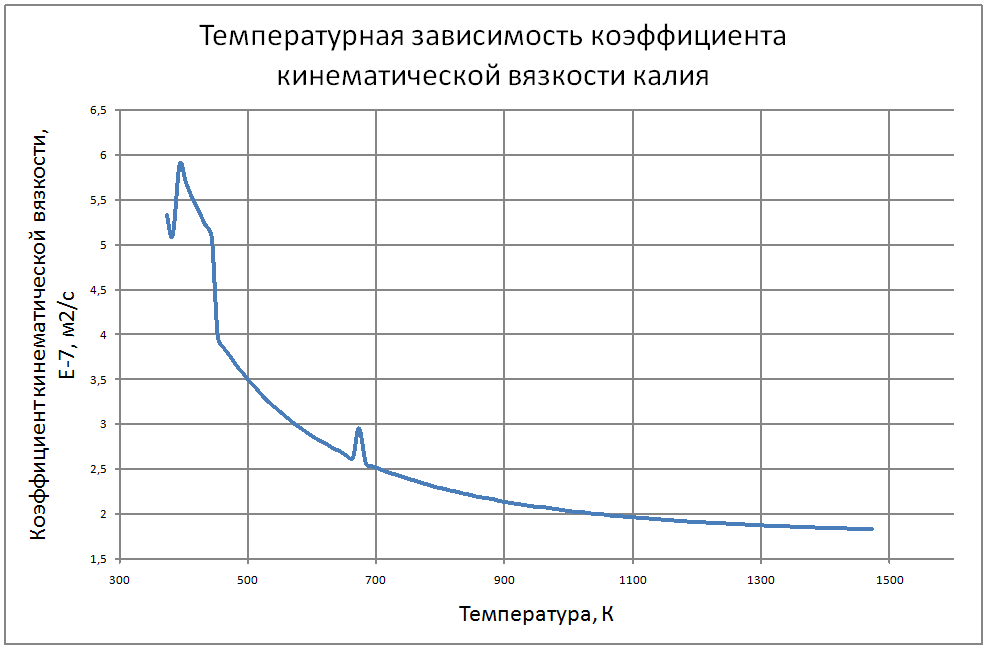
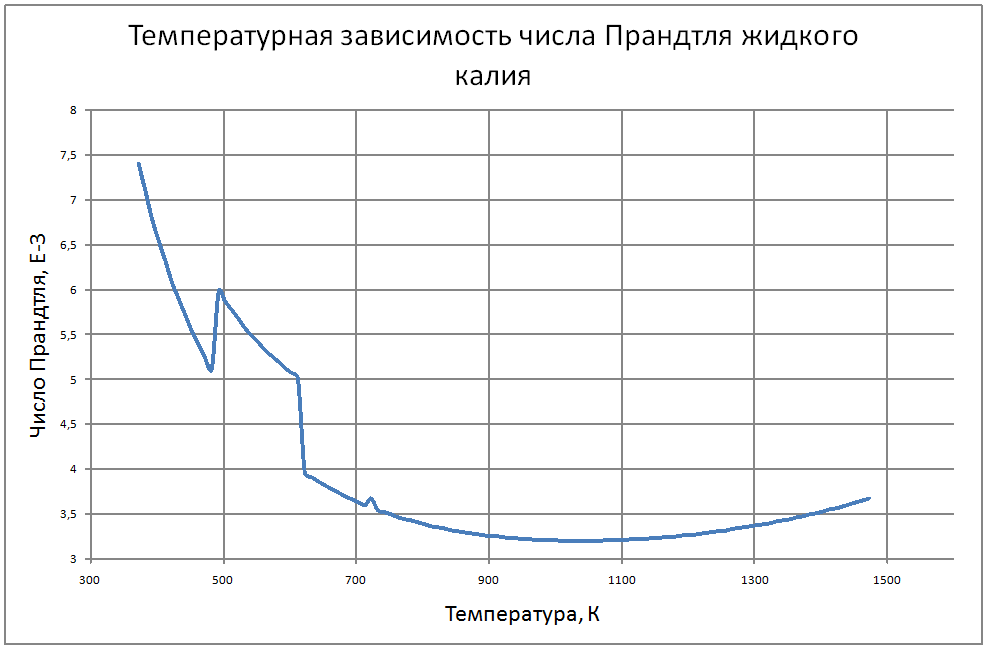
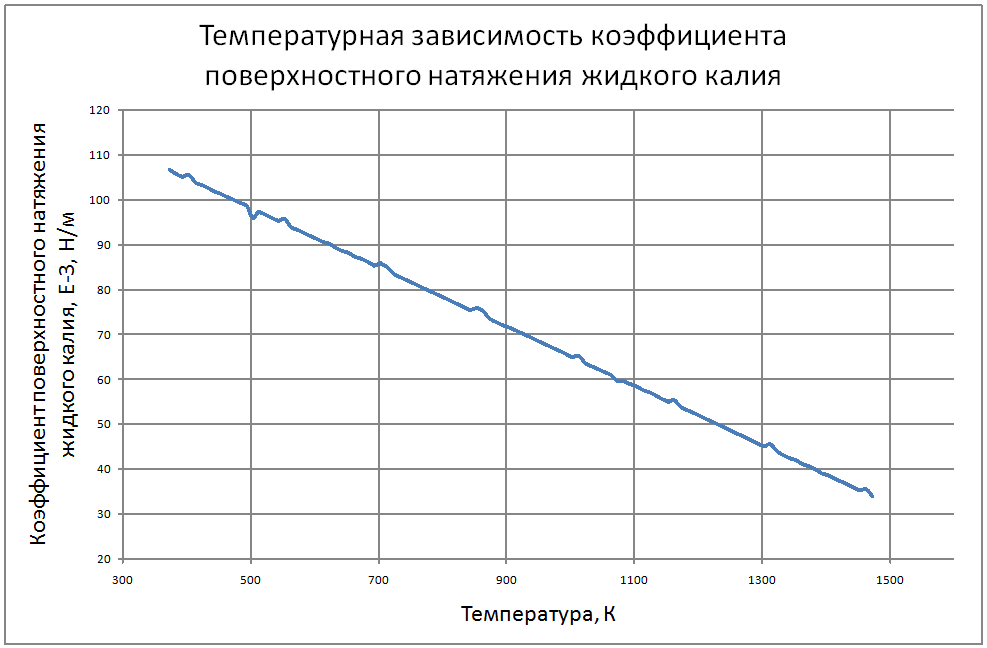
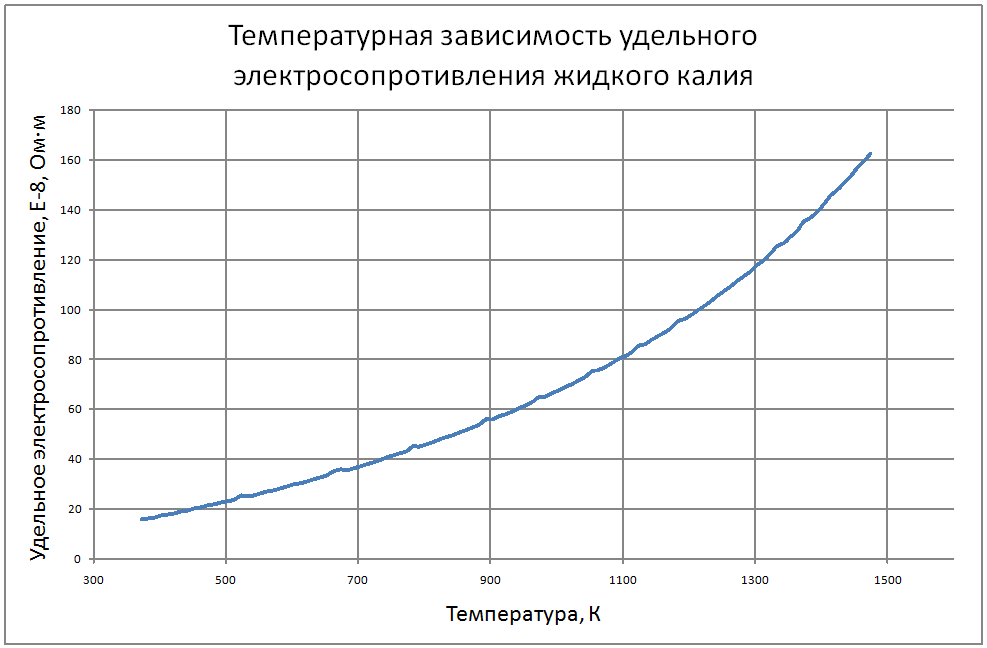
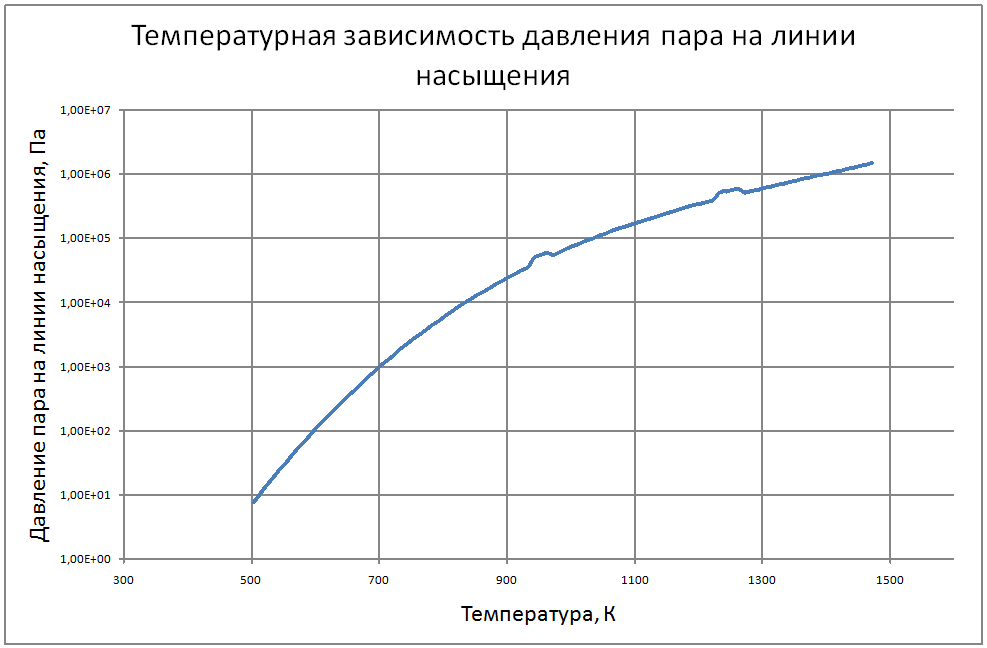
Плотность жидкого калия рассчитывается по формуле ρ = 853,1-0,297t+6,38·10-5 t2, (1) где ρ - кг/м3 ; t - °С. Пределы применимости формулы: t = 100 ÷ 1200 °С. Погрешность Δ расчета r составляет ± 0,3 %. Удельная теплоемкость жидкого калия рассчитывается по формуле: Cр = 841,3-0,3148t + 3,12·10-4 t2. (2) где C в Дж/(кг С), t в °С. Пределы применимости формулы: t = 100 ± 1200 °С. Погрешность Δ расчета C : - при t = 100 ÷ 800 °C составляет ± 1 %; - при t = 800 ÷ 1200 °С составляет ± 3 %. Коэффициент теплопроводности жидкого калия рассчитывается по формуле λ = 51,2-0,0328t + 1,066·10-5 t2. (3) где λ в Вт/(м·K): t в °С. Пределы применимости формулы: t = 100 ÷ 1200 °С. Погрешность Δ расчета λ составляет ± 3 %. Коэффициент динамической вязкости жидкого калия рассчитывается по формуле μ = 0,9673·10-5ρ1/3 exp(0,716ρ/T), (4) где μ в Па с; T в K. Погрешность Δ расчета μ составляет ±3 %. Коэффициент температуропроводности жидкого калия рассчитывается по формуле a = λ/(ρ Cp).(5) Коэффициент кинематической вязкости ν = μ/ρ (6) Число Прандтля Pr = ν/a(7) Пределы применимости формул: t = 100 ÷ 1200 °С. Погрешность Δ расчета a: - при t = 100 ÷800 °С составляет ± 0,5 %; - при t = 800 ÷1200 °С составляет ± 1 %. Коэффициент поверхностного натяжения жидкого калия рассчитывается по формуле σ = (130,5-45,72·10-3T-32,65·10-6T2+12,12·10-9T3)10-3(8) где σ- Н/м;T - °K. Давление пара на линии насыщения рассчитывается по формуле: Ps = 10M, Па, (9) M = log Ps = -9,357+0,0289T-1,936 10-5T2+4,685 10-9T3 Пределы применимости формулы: Т = 300 ÷ 1500 °С. Удельное электросопротивление рассчитывается по формуле: ρe = 10-8 [2,94 109 T-1-1,613 106+0,158 103T]-1, Ом·м. (10)
Пределы применимости формулы: Т = 300 ÷ 1500 °С. В таблице 1.2.1 приведены табулированные значения свойств для жидкого состояния. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
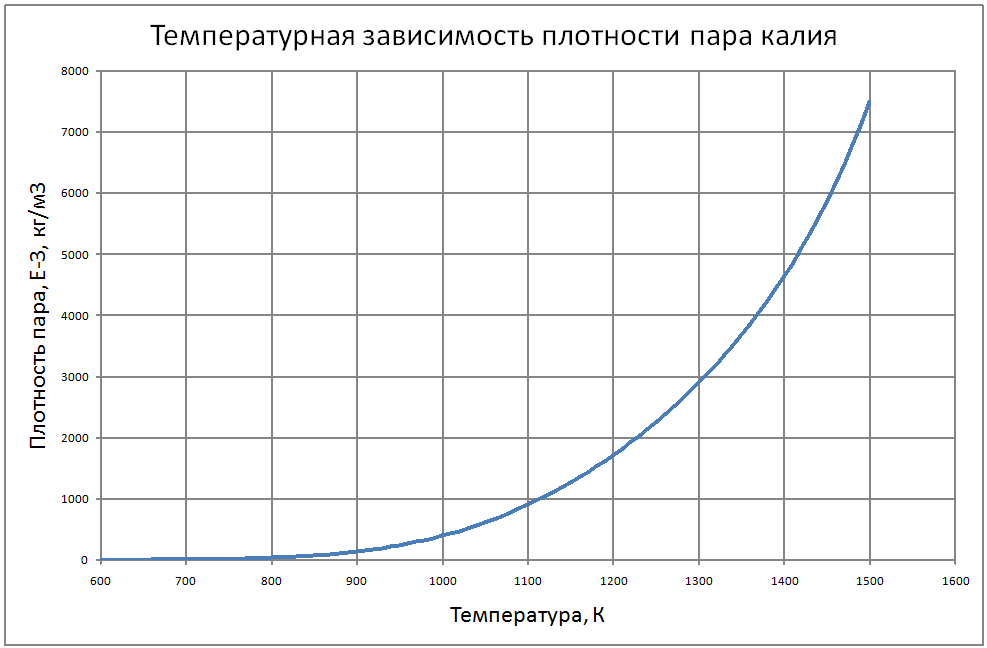
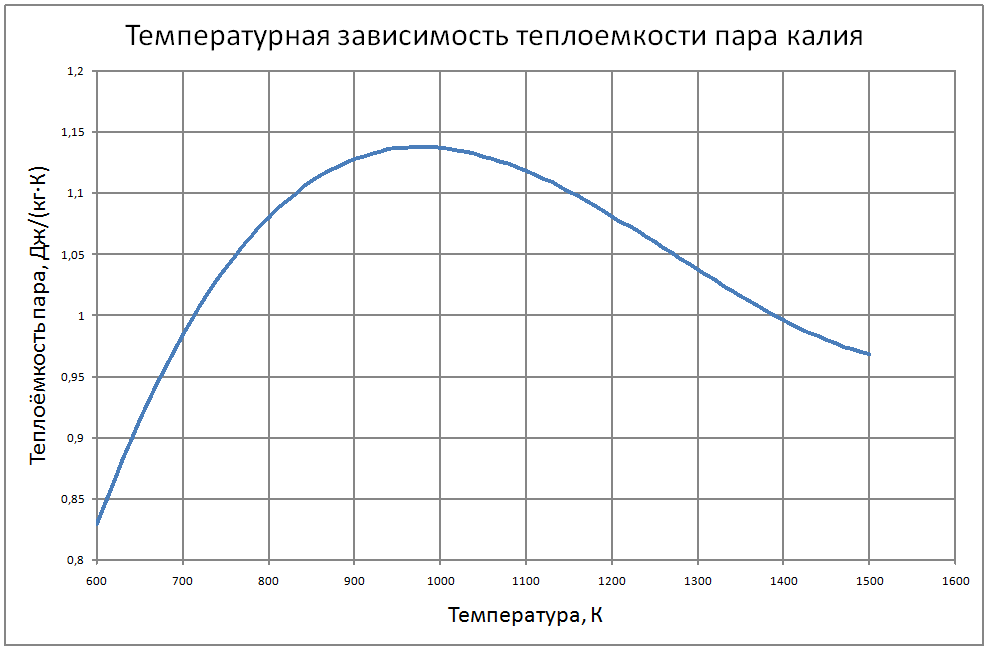
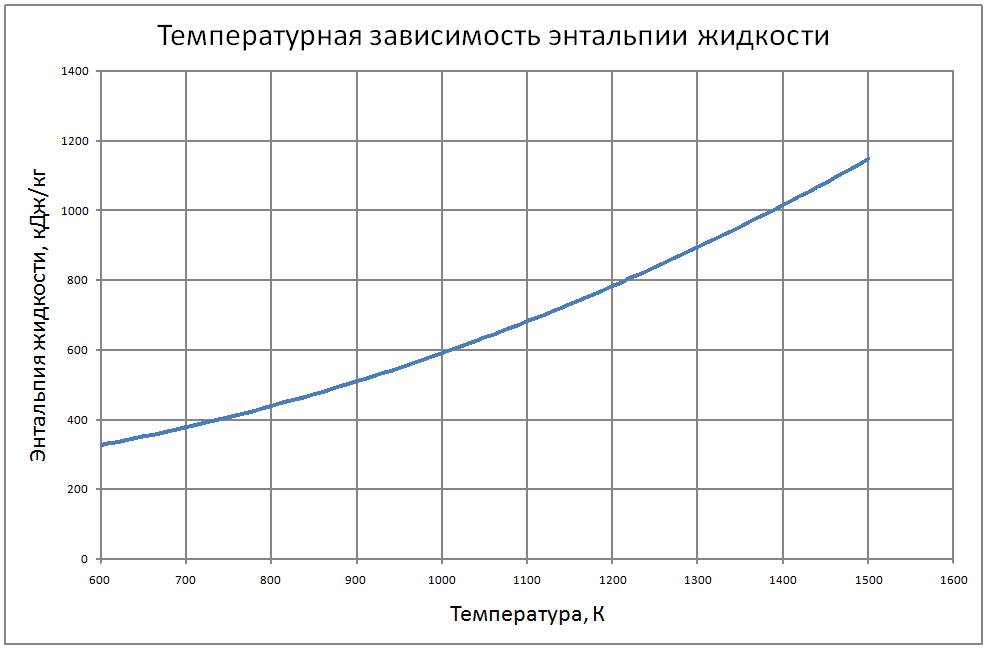
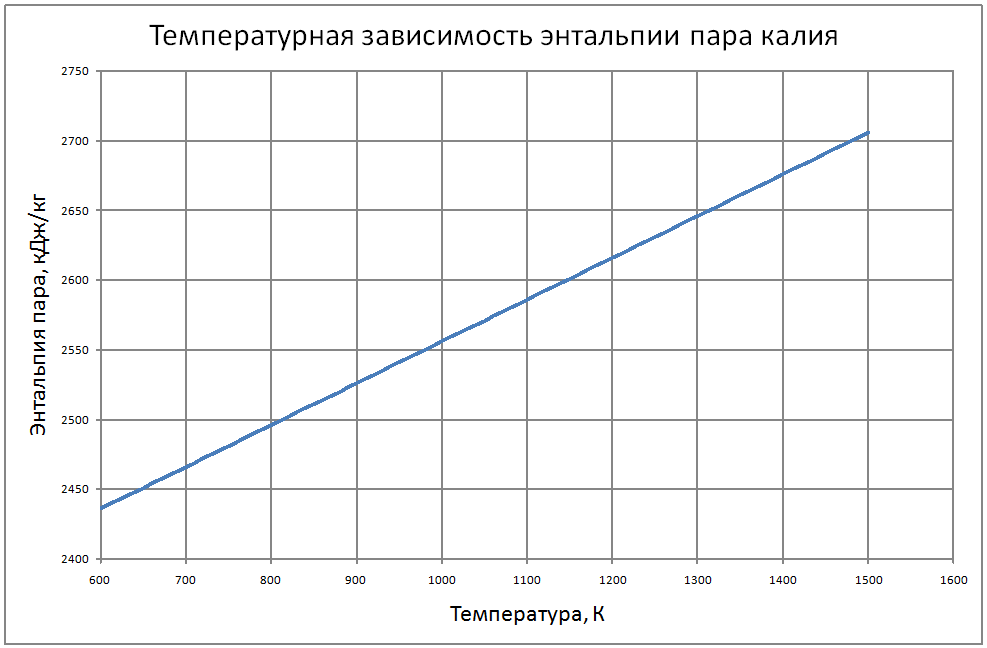
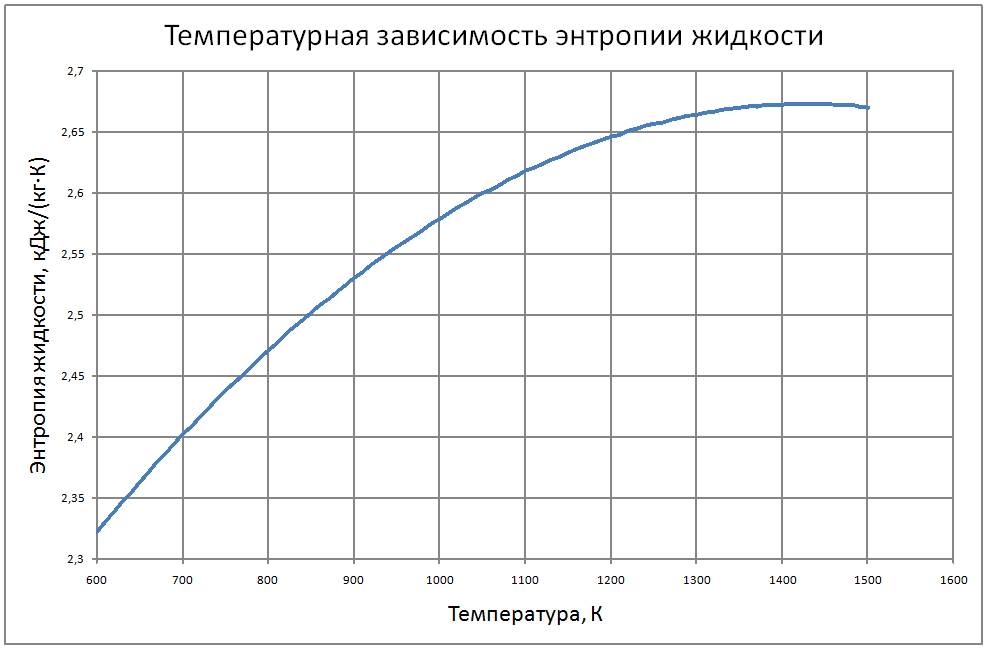
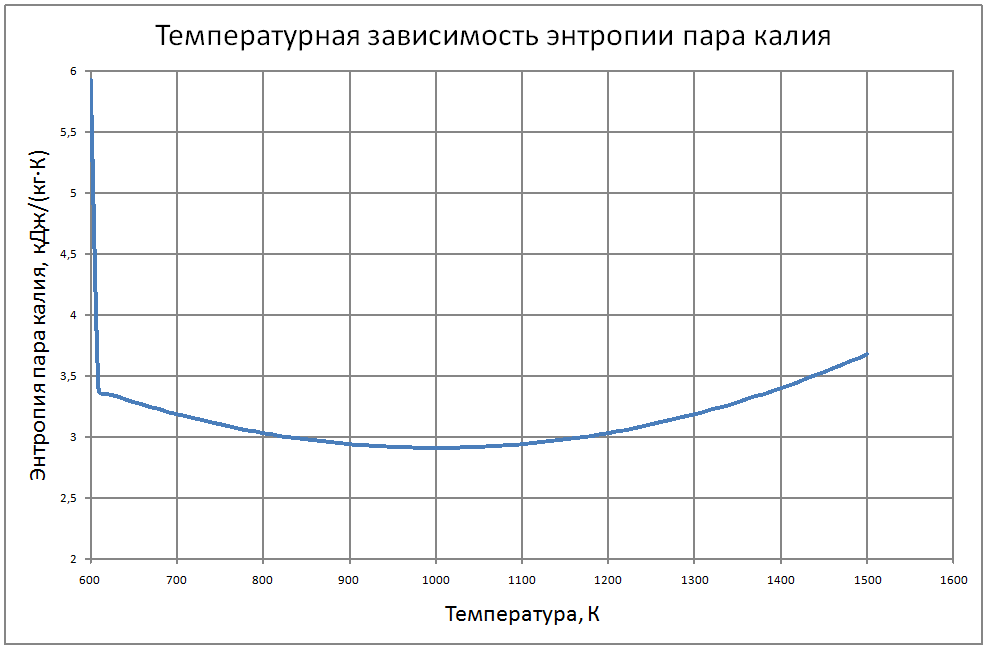
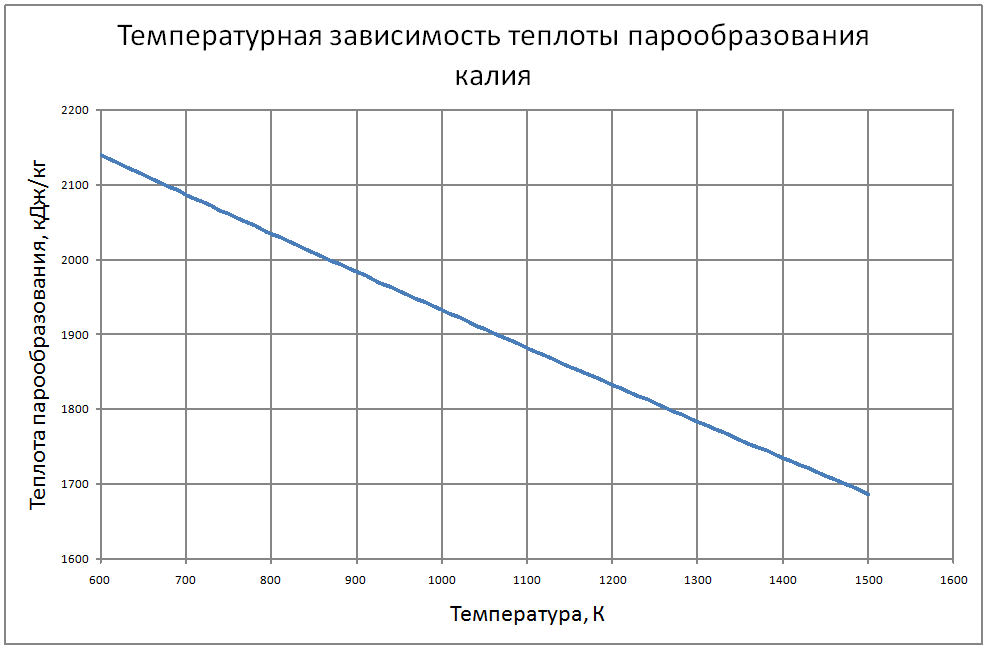
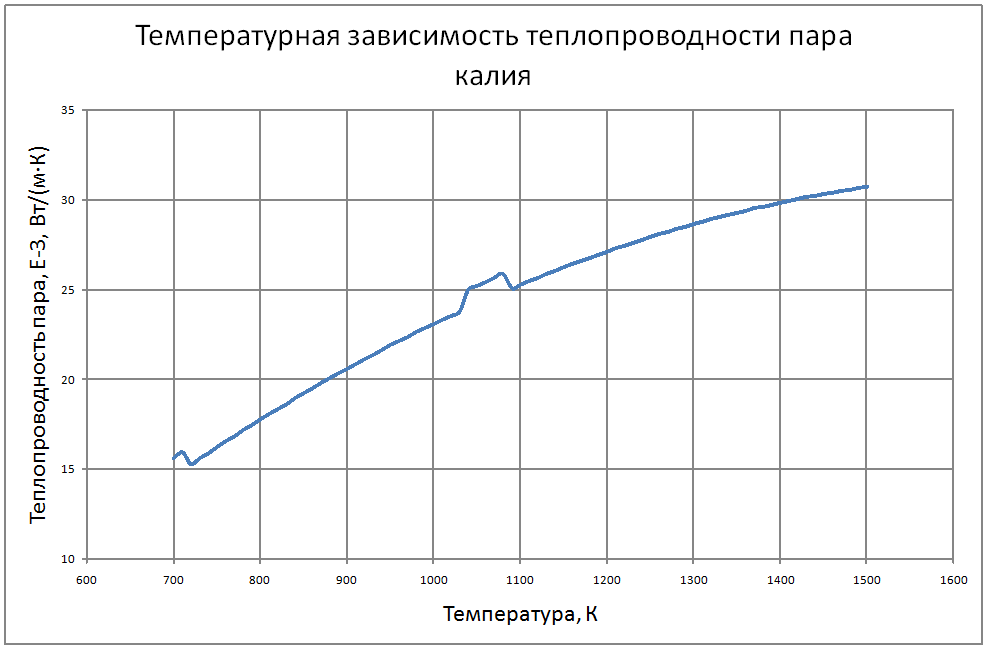
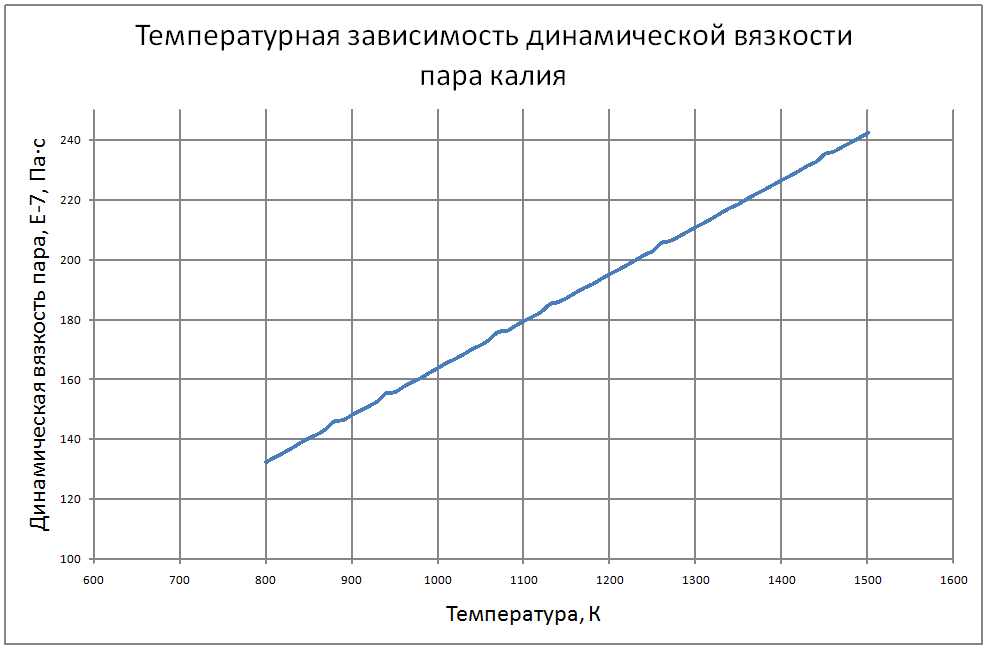
Формулы получены по таблице 2 из работы [10], погрешность аппроксимации таблиц практически равна нулю, погрешность полученных данных в [10] не приводится. Плотность пара от 700 К до 1500 К ρ" = 10m (11) m = log(ρ"103) = -11,17+0,028T-1,873·10-5 T2+4,5·10-9T3, где ρ" в кг/м3; Т в К. Теплоёмкость пара от 800 К до 1500 К Cp" = 1,92+0,0079T-6,563·10-6T2+1,72·10-9T3 (12) где Cp" – в кДж/(кг·K), T в K. Энтальпия жидкости: для интервала температур от 600 К до 1500 К H'(T)-H'(T = 600) = -65,91+0,155T+5,08·10-4Т2 (13) где H' в кДж/кг; Т в К. Энтальпия пара для интервала температур от 600 К до 1500 К H"(T) -H"(T = 600) = -176+0,3T (14) где H" в кДж/кг; Т в К. Энтропия жидкости для интервала температур от 600 К до 1500 К S'(T) -S' (T = 600) = –0,75+0,00146T–6,11·10-7T2(15) где S' в кДж/(кг·K); Т в К.Энтропия пара для интервала температур от 600 К до 1500 К S"(T) -S"(T = 600) = 4,99–0,0128T+8,77·10-6T2-2,12·10-9T3 (16) где S в кДж/(кг·K); Т в К. Теплота парообразования от 600 К до 1500 К R = 2470-0,568T+3,07·10-5T2 (17) где R в кДж/кг; Т в К. Теплопроводность пара от 700 К до 1500 К λ" = (-16,6+0,056 T-1,63 10-5T2) ·10-3(18) где λ"в Вт/(м·К); Т в К. Динамическая вязкость пара от 600 К до 1500 К μ" = (6,77+0,157T) ·10-7 (19) где μ" в Па·с; Т в К. В таблице ниже приведены реперные значения свойств на линии насыщения из [11]. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Описана методика расчета термодинамических функций на основе групповых разложений с использованием полученного ранее полуэмпирического уравнения состояния. Погрешность результатов подсчитывается как сумма перенесенной погрешности исходных экспериментальных данных и систематической ошибки от неучета старших групповых интегралов, возникающей при экстраполяции уравнения состояния в область высоких плотностей. Выполнено сравнение результатов расчета с экспериментальными данными о теплоемкости и скорости звука в парах калия, которые не использовались при построении уравнения состояния, а также с расчетными данными других авторов. Приведены таблицы термодинамических свойств паров натрия и калия и погрешностей этих величин при температурах 800 - 2000 К и давлениях 0,01 - 5 МПа. Оценки термодинамических функций и их погрешностей. В [55] построены полуэмпирические уравнения состояния паров натрия и калия в виде разложений давления p и мольной плотности ρ по степеням активности ζ исходных атомов
В [56] проанализированы полученные в результате оценки групповых интегралов bj(T). Групповые разложения других термодинамических функций, аналогичные (1), (2), - энтальпии h, энтропии s, обратной изотермической сжимаемости (∂p/∂ρ)T, термического коэффициента давления (∂p/∂T)ρ, изохорной cv и изобарной cp теплоемкостей, адиабатной скорости звука a = [(cp/cv) (∂p/∂γ)T]½ приведены в [55, 57] и содержат групповые интегралы, а также их первые и вторые производные по температуре. Таким образом, используя найденные в [55] оценки параметров â1, ..., âm, определяющих температурные зависимости групповых интегралов, можно оценить значения любых представляющих интерес термодинамических функций рассматриваемых веществ, хотя для построения уравнения состояния потребовались лишь данные о плотности этих веществ и о потенциалах межатомного взаимодействия. Чтобы вычислить значение некоторой термодинамической функции g при заданных Т и р на основе ее группового разложения g = φ(T,ζ), решаем при этих Т и p уравнение (1) относительно ζ) (численно) и подставляем его корень ζ(T,p) в требуемое групповое разложение: g(T, р) = φ[T, ζ(T,p)]. Уровень значимости предсказываемых таким способом термодинамических функций оценивался путем вычисления по правилу переноса ошибок среднеквадратичных отклонений Δидg, обусловленных погрешностью исходных данных, при использовании с этой целью рассчитанной в [55] ковариационной матрицы оценок параметров covij(â)
Поскольку термодинамические функции зависят от параметров â1, ..., âm как непосредственно (через групповые интегралы и их производные), так и косвенно (через активность), формулы для вычисления величин (3) очень громоздки и здесь не приводятся: они подробно выписаны в [58]. Погрешности стандартных термодинамических функций одноатомных паров Na и К, затабулированных в [59] и аппроксимированных авторами предлагаемой работы, пренебрежимо малы по сравнению с (3). Так как полученное полуэмпирическое уравнение состояния теоретически обосновано, рассчитанные на его основе значения термодинамических функций не содержат каких-либо дополнительных погрешностей, помимо перенесенной погрешности исходных экспериментальных данных (3), в том числе, вообще говоря, и при температурах и давлениях, выходящих за пределы области параметров состояния, в которой располагаются исходные данные (T < 1700 К, p < 3 МПа). Однако при значительном удалении от этой области в сторону высоких плотностей появляется дополнительная систематическая погрешность, вызванная отсутствием в уравнении состояния (1), (2) членов, содержащих пятый и старшие групповые интегралы, которые, как указано в [55, 2], невозможно оценить по имеющимся экспериментальным данным. Хорошо обоснованного способа оценки a priori величин bj(T) при j ≥ 5 для паров Na и К в настоящее время, насколько нам известно, не существует. Поэтому ниже предлагается заведомо грубый экстраполяционный способ оценки указанных величин. Эти величины затем используются для расчета возможного вклада в термодинамические функции g от неучтенной суммы старших членов группового разложения Δэg который целиком рассматривается как дополнительная погрешность расчета в «области экстраполяции». Экстраполяционный расчет термодинамических функций основан на асимптотических оценках групповых интегралов [60], подтверждающихся результатами [55]. bj ~ exp[E(j/2)De/kT] (4) (Е(х)- целая часть х). С учетом (4) разделены вклады четных и нечетных членов ряда (1) p = pнеч + pчет (5) и предполагается, что каждое из слагаемых в правой части (5) можно приближенно заменить суммой, соответствующей бесконечно убывающей геометрической прогрессии
где γ = b3ζ2 и
где δ = (b4/b2)ζ2. Окончательно
Первые четыре члена разложения (6) по степеням активности ζ полностью совпадают с (1). Последующие члены разложения (6) дают экстраполяционные оценки старших групповых интегралов по b2, b3, b4
Используя термодинамические соотношения большого канонического ансамбля, из (6) нетрудно найти аналогичные «аппроксиманты Паде» групповых разложений и других термодинамических функций. Например,
Оценку систематической погрешности расчета термодинамической функции g от неучета старших членов группового разложения Δэg найдем, вычитая из величины gэ(T,р), вычисленной по (6), (8), значение g(T,р), полученное на основе четырехчленного полуэмпирического уравнения состояния (1), (2),
Однако, по-видимому, эта оценка несколько завышена: как показали расчеты, величина (9) сравнивается с (3) уже при p ≈ 1 МПа, в то время как на самом деле групповые интегралы старше четвертого не могут быть оценены по исходным экспериментальным данным, следовательно, их вклад меньше (3) вплоть до р ≤ 2,5 МПа. Поэтому погрешность результатов расчета термодинамических функций при р ? 3 МПа полагалась равной утроенной (в соответствии с правилом «трех сигм») величине (3), а систематическая погрешность (9) дополнительно учитывалась лишь при p > 3 МПа, т. е. в «области экстраполяции»
Сравнение результатов расчета с литературными данными. В первую очередь такое сравнение полезно провести с экспериментальными данными о плотности [61], изобарной теплоемкости [62] и адиабатной скорости звука [63] пара калия, которые при построении уравнения состояния не использовались. Соответствующие материалы представлены в табл. 1 - 3. Таблица 1. Сравнение результатов расчета плотности пара калия с экспериментальными данными [61]
Таблица 2. Сравнение результатов расчета изобарной теплоемкости пара калия с экспериментальными данными [62]
Таблица 3. Сравнение результатов расчета адиабатной скорости звука пара калия с экспериментальными данными [63]
Совпадение наших расчетов плотности пара калия с результатами измерений [61] свидетельствует не только о точности полуэмпирического уравнения состояния, но и о его экстраполяционных возможностях, поскольку данные [61] частично лежат в области параметров состояния, значительно выходящей за пределы температур и давлений, в которых это уравнение получено. Можно констатировать хорошее согласие нашего расчета с данными [62] о теплоемкости, имеющими, по оценке авторов, погрешность 3 %: расхождения носят случайный характер и укладываются в суммарную погрешность расчета и эксперимента. В то же время результаты нашего расчета систематически (в среднем на 1,5 %) занижены по отношению к данным [63] о скорости звука, погрешность которых, по оценке автора, менее 0,5 %. Такие расхождения заметно превышают суммарную погрешность расчета и эксперимента (0,7 - 0,9 %), и их причина пока не ясна. Впрочем, сами по себе эти расхождения не столь уж велики, и в целом результаты сравнения полуэмпирического уравнения состояния с экспериментом можно признать удовлетворительными. Сопоставим далее наши данные с результатами расчетов термодинамических свойств паров Na и К, выполненных ранее (критический обзор на эту тему приведен в [55]). Относительные отклонения от рассчитанных нами значений - средние (верхняя цифра соответствующей колонки в данной графе) и максимальные (нижняя цифра) - приведены в табл. 4. Таблица 4. Относительные отклонения результатов расчетов термодинамических функций паров натрия и калия (литературные данные) от данных авторов (в %)
Результаты расчета плотности γ = Mρ по интерполяционным «псевдовириальным» уравнениям состояния [63, 64], как и следовало ожидать, отклоняются от наших данных в пределах утроенного среднеквадратичного отклонения исходных данных. Наилучшее совпадение имеет место для энтропии - термодинамической функции, наименее чувствительной к нюансам поведения уравнения состояния. Зато очень велики отличия в значениях изобарной теплоемкости, причем их знак в работах [63, 64] противоположен. Такие расхождения, несомненно, свидетельствуют о том, что «псевдовириальные коэффициенты» [56], использованные в [63, 64], заметно и притом незакономерным образом искажают характер кривизны термодинамической поверхности, к которой особенно чувствительна теплоемкость. Плотность пара натрия, рассчитанная в [65], превосходно согласуется с нашими данными во всем охваченном в [65] диапазоне параметров (1000 - 1600 К, 0,01 - 1 МПа), что объясняется близостью констант равновесия «квазихимического» уравнения состояния [65] нашим групповым интегралам [56]. К сожалению, отличия по другим термодинамическим; функциям выходят за границы разумного: так, при 1500 К и 0,01 МПа, когда не только неидеальность, но и образование димеров практически не оказывают влияния на термодинамическое поведение пара натрия, расхождение в энтропии составляет 1,5 %. По-видимому, в [65] приняты ошибочные стандартные термодинамические функции одноатомного пара Na, что, конечно, весьма удивительно. Значительные расхождения наших результатов с данными справочника [66] вызваны в основном неправдоподобно большими значениями принятого там второго вириального коэффициента, учитывающего поправку на неидеальность за счет взаимодействия мономеров [55]. В случае калия- эта ошибка частично компенсируется неточностью принятого в [66] значения энергии диссоциации димера К2. Как видно из последней графы табл. 4, значения термодинамических функций, рассчитанные в [66] в идеально-газовом приближении, ближе к действительности, чем с учетом неидеальности. Уже после того, как эта работа была сдана в печать, появился обзор [67], в котором на основе экспериментальных данных о плотности, указанных в [55], получены интерполяционные уравнения состояния пара натрия при 960 ≤ T ≤ 1700 К, 0,01 ≤ p ≤ 2,5 МПа и калия при 840 ≤ T ≤ 1700 К, 0,01 ≤ p ≤ 2,5 МПа, имеющие вид «псевдовириального» разложения давления по степеням плотности до четвертой включительно, и на их основе рассчитаны таблицы термодинамических свойств. Расхождения с результатами настоящей работы таковы: для натрия по плотности не более 0,4 %, по энтальпии и энтропии - менее 0,5 %, по скорости звука - до 1 %, по теплоемкости сp - до 5 %; для калия по плотности до 1 % при низких температурах и давлениях и не более 0,5 % при повышенных, по энтальпии - не более 0,5 %, по энтропии - менее 0,3 %, по скорости звука - до 2 % при низких температурах и давлениях и не более 0,5 % при повышенных, по теплоемкости сp - до 5 - 10 %, а при самых низких Т и р - до 20 %. Указанные расхождения превышают оцененные погрешности расчета термодинамических функций, причем для скорости звука и особенно теплоемкости - значительно. По-видимому, они вызваны различием в формах уравнения состояния, иным выбором авторами [67] по сравнению с [55] весовых множителей при обработке как разных данных, так и разных серий одного и того же эксперимента, и, наконец, включением в обработку недостаточно надежных низкотемпературных данных о плотности пара калия. В целом проведенный выше анализ позволяет авторам надеяться, что результаты расчета термодинамических свойств паров натрия и калия, полученные в предлагаемой работе, наиболее надежны по сравнению с имеющимися в настоящее время литературными данными. Таблицы термодинамических функций. В табл. 7 приведены результаты расчета безразмерного отношения активности ζ к величине р/RT (поскольку f = ζRT - летучесть, или фугитивность, то указанное отношение представляет собой коэффициент летучести f/p), массовой плотности γ = Mρ (М - атомная масса), энтальпии h, энтропии s и изобарной теплоемкости ср, отношения ср/cv и адиабатной скорости звука а паров натрия и калия. В табл. 8 - погрешности перечисленных величин, рассчитанные по (10). Таблицы охватывают состояния перегретых и (частично) переохлажденных (на 100 -150 К) паров. Величина ζRT/р, как отмечено в [56], может служить оценкой мольной доли мономеров x1. Таблиц 7. Термодинамические свойства пара калия
Таблиц 8. Погрешности результатов расчета термодинамических свойств пара калия
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 (1)
(1) (2)
(2) (3)
(3)

 (6)
(6) (7)
(7)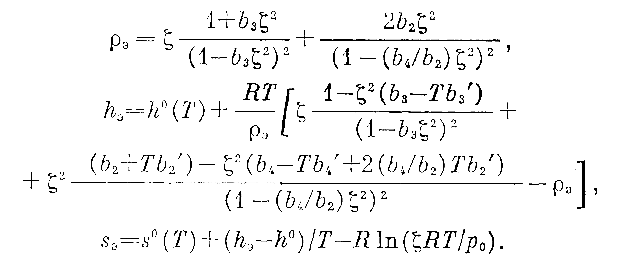 (8)
(8) (9)
(9)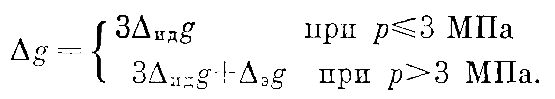 (10)
(10)